diagramme potentiel ph
DownloadTélécharger
Actions
Vote :
ScreenshotAperçu
Informations
Catégorie :Category: mViewer GX Creator Lua TI-Nspire
Auteur Author: omar1998
Type : Classeur 3.6
Page(s) : 8
Taille Size: 659.56 Ko KB
Mis en ligne Uploaded: 12/03/2019 - 17:44:21
Uploadeur Uploader: omar1998 (Profil)
Téléchargements Downloads: 51
Visibilité Visibility: Archive publique
Shortlink : https://tipla.net/a1971401
Type : Classeur 3.6
Page(s) : 8
Taille Size: 659.56 Ko KB
Mis en ligne Uploaded: 12/03/2019 - 17:44:21
Uploadeur Uploader: omar1998 (Profil)
Téléchargements Downloads: 51
Visibilité Visibility: Archive publique
Shortlink : https://tipla.net/a1971401
Description
Sciences Physiques - Chimie MPSI
Partie 8 : Transformations chimiques en sol aqueuse - Ch.4 : Diagrammes potentiel-pH
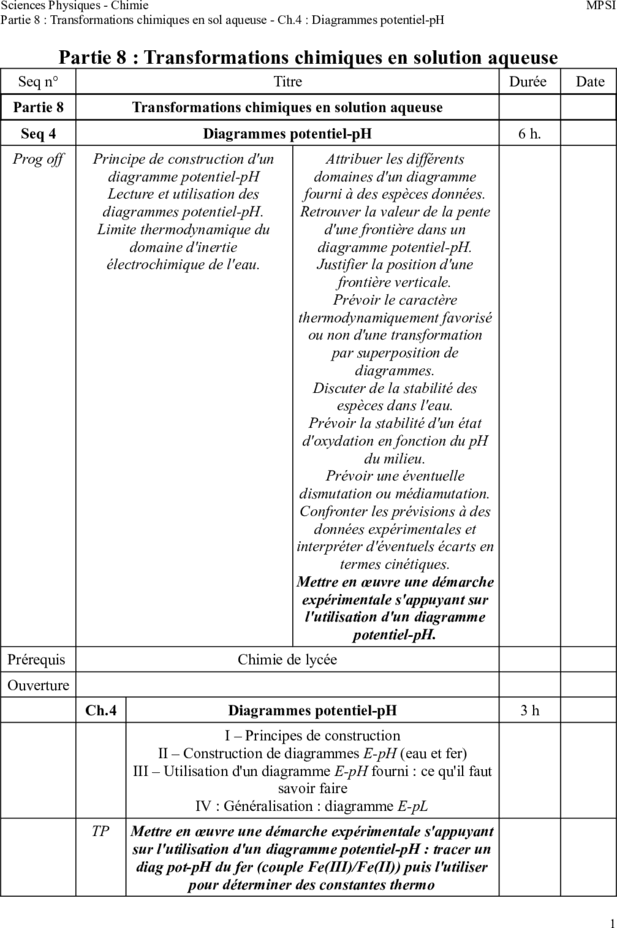
Partie 8 : Transformations chimiques en solution aqueuse
Seq n° Titre Durée Date
Partie 8 Transformations chimiques en solution aqueuse
Seq 4 Diagrammes potentiel-pH 6 h.
Prog off Principe de construction d'un Attribuer les différents
diagramme potentiel-pH domaines d'un diagramme
Lecture et utilisation des fourni à des espèces données.
diagrammes potentiel-pH. Retrouver la valeur de la pente
Limite thermodynamique du d'une frontière dans un
domaine d'inertie diagramme potentiel-pH.
électrochimique de l'eau. Justifier la position d'une
frontière verticale.
Prévoir le caractère
thermodynamiquement favorisé
ou non d'une transformation
par superposition de
diagrammes.
Discuter de la stabilité des
espèces dans l'eau.
Prévoir la stabilité d'un état
d'oxydation en fonction du pH
du milieu.
Prévoir une éventuelle
dismutation ou médiamutation.
Confronter les prévisions à des
données expérimentales et
interpréter d'éventuels écarts en
termes cinétiques.
Mettre en œuvre une démarche
expérimentale s'appuyant sur
l'utilisation d'un diagramme
potentiel-pH.
Prérequis Chimie de lycée
Ouverture
Ch.4 Diagrammes potentiel-pH 3h
I – Principes de construction
II – Construction de diagrammes E-pH (eau et fer)
III – Utilisation d'un diagramme E-pH fourni : ce qu'il faut
savoir faire
IV : Généralisation : diagramme E-pL
TP Mettre en œuvre une démarche expérimentale s'appuyant
sur l'utilisation d'un diagramme potentiel-pH : tracer un
diag pot-pH du fer (couple Fe(III)/Fe(II)) puis l'utiliser
pour déterminer des constantes thermo
1
Sciences Physiques - Chimie MPSI
Partie 8 : Transformations chimiques en sol aqueuse - Ch.4 : Diagrammes potentiel-pH
Seq n° Titre Durée Date
TD Exercices 3h
DM
DS Concours Blanc
2
Sciences Physiques - Chimie MPSI
Partie 8 : Transformations chimiques en sol aqueuse - Ch.4 : Diagrammes potentiel-pH
Ch.4 Diagrammes potentiel-pH
Les diagrammes de prédominance ou d'existence sont tracés en fonction du pH (cas des
couples acide-base), en fonction du potentiel E (cas des couples oxydant-réducteur), ou en fonction
de pC =−logC (cas des couples solide/solide dissout).
Il est alors possible de construire des diagrammes bidimensionnels en fonction à la fois de E
et pH (ou E et pC) appelé diagramme potentiel-pH : E-pH (ou E-pC).
I. Principes de construction
• Le diagramme E-pH est aussi appelé diagramme de Pourbaix, du nom de l’électro-chimiste
belge qui proposa ces diagrammes en 1938.
• Axe des abscisses : pH / axe des ordonnées : E.
• La température est fixée à 25°C, ce qui nous permet d'utiliser la formule de Nernst
0 0,06 a αOx
simplifiée : E Ox/Red =E Ox/Red+ log β
n a Red
I.1. Conventions de tracé
• L'activité des espèces solides et du solvant est de 1.
• La pression des espèces à l'état gazeux est fixée à une pression arbitraire : P=P 0=1 bar
• La concentration de chacune des formes dissoutes dans son domaine de prédominance est
égale à une concentration frontière dite concentration de tracé C0, fixée arbitrairement.
• Les frontières entre une forme en solution et une forme solide (précipité ou complexe)
correspondent à la limite d'apparition de la phase solide, la forme dissoute ayant la
concentration de tracé C0.
I.2. Protocole de construction du diagramme
a. Étape 1 : n.o et frontières de pH → diagramme « primitif » : n.o = f(pH)
• Faire l'inventaire des espèces étudiées et les classer par n.o croissant (frontière entre n.o :
frontière horizontale (ou avec une pente qu'il faudra déterminer)).
• Si plusieurs espèces correspondent à un même n.o, les classer selon leur caractère acido-
basique (frontière de pH).
→ tracé des frontières de pH : ces frontières sont toujours verticales. Elles valent le pKA
du couple acide-base, ou, dans le cas d'un précipité (ou d'un complexe), elles valent le
pH d'apparition du précipité (ou du complexe).
b. Étape 2 : Tracé des frontières entre n.o
• Si aucun proton H+ n'est échangé, la frontière entre 2 n.o sera horizontale.
• Si il y a échange de proton, la formule de Nernst permettra de calculer la pente.
Remarque : Le potentiel d'une solution est unique, et correspond au potentiel de tous les
couples présents à un moment donné dans le milieu. Il y a donc nécessairement continuité
du potentiel, ce qui permet de calculer les valeurs frontières de potentiel ou de vérifier des
calculs.
c. Étape 3 : Vérifier que toutes les espèces ont un domaine de prédominance
• Si chaque espèce a un domaine de prédominance, il s'agit du diagramme définitif.
• Si une même espèce a 2 domaines disjoints, il y a dismutation. Il faut faire disparaître cette
espèce du diagramme et calculer la nouvelle frontière entre les 2 n.o.
3
Sciences Physiques - Chimie MPSI
Partie 8 : Transformations chimiques en sol aqueuse - Ch.4 : Diagrammes potentiel-pH
d. Rôle de l'eau
Une fois le diagramme d'un élément obtenu, il est intéressant de superposer le diagramme de
l'eau pour vérifier quelles réactions peuvent avoir lieu en solution aqueuse. Si le domaine de
prédominance d'une espèce est disjoint avec celui de l'eau, alors il y a réaction. Sinon, il n'y a pas
réaction avec l'eau.
II. Construction de diagrammes E-pH : exemple de l'eau et du fer
II.1. Diagramme E-pH de l'eau solvant
Ce diagramme est à connaître par cœur, puisqu'il intervient dans toutes solutions aqueuses.
Ici, comme l'eau est une espèce amphotère rédox, on étudie les 2 couples rédox : l'eau est
+ 0 0
oxydant du couple H 2 O / H 2 ( H / H 2 en milieu acide) : E 1=E H / H =0,00 V et réducteur du
+
2
couple O2 / H 2 O : E 02=1,23 V .
• Frontières de pH :
◦ le domaine de prédominance de H2O est compris entre pH=0 et pH=14, qui sont les
valeurs limites de pH en solution aqueuse. On n'a donc pas de frontières horizontales.
• Frontières E-pH :
+ − 1 + − 1
◦ Couple H 2 O / H 2 : H 2 O+H +e = H 2+ H 2 O ⇔ H +e = H 2
2 2
0 h
Donc : E 1=E 1+0,06 log
0
...
Partie 8 : Transformations chimiques en sol aqueuse - Ch.4 : Diagrammes potentiel-pH
Partie 8 : Transformations chimiques en solution aqueuse
Seq n° Titre Durée Date
Partie 8 Transformations chimiques en solution aqueuse
Seq 4 Diagrammes potentiel-pH 6 h.
Prog off Principe de construction d'un Attribuer les différents
diagramme potentiel-pH domaines d'un diagramme
Lecture et utilisation des fourni à des espèces données.
diagrammes potentiel-pH. Retrouver la valeur de la pente
Limite thermodynamique du d'une frontière dans un
domaine d'inertie diagramme potentiel-pH.
électrochimique de l'eau. Justifier la position d'une
frontière verticale.
Prévoir le caractère
thermodynamiquement favorisé
ou non d'une transformation
par superposition de
diagrammes.
Discuter de la stabilité des
espèces dans l'eau.
Prévoir la stabilité d'un état
d'oxydation en fonction du pH
du milieu.
Prévoir une éventuelle
dismutation ou médiamutation.
Confronter les prévisions à des
données expérimentales et
interpréter d'éventuels écarts en
termes cinétiques.
Mettre en œuvre une démarche
expérimentale s'appuyant sur
l'utilisation d'un diagramme
potentiel-pH.
Prérequis Chimie de lycée
Ouverture
Ch.4 Diagrammes potentiel-pH 3h
I – Principes de construction
II – Construction de diagrammes E-pH (eau et fer)
III – Utilisation d'un diagramme E-pH fourni : ce qu'il faut
savoir faire
IV : Généralisation : diagramme E-pL
TP Mettre en œuvre une démarche expérimentale s'appuyant
sur l'utilisation d'un diagramme potentiel-pH : tracer un
diag pot-pH du fer (couple Fe(III)/Fe(II)) puis l'utiliser
pour déterminer des constantes thermo
1
Sciences Physiques - Chimie MPSI
Partie 8 : Transformations chimiques en sol aqueuse - Ch.4 : Diagrammes potentiel-pH
Seq n° Titre Durée Date
TD Exercices 3h
DM
DS Concours Blanc
2
Sciences Physiques - Chimie MPSI
Partie 8 : Transformations chimiques en sol aqueuse - Ch.4 : Diagrammes potentiel-pH
Ch.4 Diagrammes potentiel-pH
Les diagrammes de prédominance ou d'existence sont tracés en fonction du pH (cas des
couples acide-base), en fonction du potentiel E (cas des couples oxydant-réducteur), ou en fonction
de pC =−logC (cas des couples solide/solide dissout).
Il est alors possible de construire des diagrammes bidimensionnels en fonction à la fois de E
et pH (ou E et pC) appelé diagramme potentiel-pH : E-pH (ou E-pC).
I. Principes de construction
• Le diagramme E-pH est aussi appelé diagramme de Pourbaix, du nom de l’électro-chimiste
belge qui proposa ces diagrammes en 1938.
• Axe des abscisses : pH / axe des ordonnées : E.
• La température est fixée à 25°C, ce qui nous permet d'utiliser la formule de Nernst
0 0,06 a αOx
simplifiée : E Ox/Red =E Ox/Red+ log β
n a Red
I.1. Conventions de tracé
• L'activité des espèces solides et du solvant est de 1.
• La pression des espèces à l'état gazeux est fixée à une pression arbitraire : P=P 0=1 bar
• La concentration de chacune des formes dissoutes dans son domaine de prédominance est
égale à une concentration frontière dite concentration de tracé C0, fixée arbitrairement.
• Les frontières entre une forme en solution et une forme solide (précipité ou complexe)
correspondent à la limite d'apparition de la phase solide, la forme dissoute ayant la
concentration de tracé C0.
I.2. Protocole de construction du diagramme
a. Étape 1 : n.o et frontières de pH → diagramme « primitif » : n.o = f(pH)
• Faire l'inventaire des espèces étudiées et les classer par n.o croissant (frontière entre n.o :
frontière horizontale (ou avec une pente qu'il faudra déterminer)).
• Si plusieurs espèces correspondent à un même n.o, les classer selon leur caractère acido-
basique (frontière de pH).
→ tracé des frontières de pH : ces frontières sont toujours verticales. Elles valent le pKA
du couple acide-base, ou, dans le cas d'un précipité (ou d'un complexe), elles valent le
pH d'apparition du précipité (ou du complexe).
b. Étape 2 : Tracé des frontières entre n.o
• Si aucun proton H+ n'est échangé, la frontière entre 2 n.o sera horizontale.
• Si il y a échange de proton, la formule de Nernst permettra de calculer la pente.
Remarque : Le potentiel d'une solution est unique, et correspond au potentiel de tous les
couples présents à un moment donné dans le milieu. Il y a donc nécessairement continuité
du potentiel, ce qui permet de calculer les valeurs frontières de potentiel ou de vérifier des
calculs.
c. Étape 3 : Vérifier que toutes les espèces ont un domaine de prédominance
• Si chaque espèce a un domaine de prédominance, il s'agit du diagramme définitif.
• Si une même espèce a 2 domaines disjoints, il y a dismutation. Il faut faire disparaître cette
espèce du diagramme et calculer la nouvelle frontière entre les 2 n.o.
3
Sciences Physiques - Chimie MPSI
Partie 8 : Transformations chimiques en sol aqueuse - Ch.4 : Diagrammes potentiel-pH
d. Rôle de l'eau
Une fois le diagramme d'un élément obtenu, il est intéressant de superposer le diagramme de
l'eau pour vérifier quelles réactions peuvent avoir lieu en solution aqueuse. Si le domaine de
prédominance d'une espèce est disjoint avec celui de l'eau, alors il y a réaction. Sinon, il n'y a pas
réaction avec l'eau.
II. Construction de diagrammes E-pH : exemple de l'eau et du fer
II.1. Diagramme E-pH de l'eau solvant
Ce diagramme est à connaître par cœur, puisqu'il intervient dans toutes solutions aqueuses.
Ici, comme l'eau est une espèce amphotère rédox, on étudie les 2 couples rédox : l'eau est
+ 0 0
oxydant du couple H 2 O / H 2 ( H / H 2 en milieu acide) : E 1=E H / H =0,00 V et réducteur du
+
2
couple O2 / H 2 O : E 02=1,23 V .
• Frontières de pH :
◦ le domaine de prédominance de H2O est compris entre pH=0 et pH=14, qui sont les
valeurs limites de pH en solution aqueuse. On n'a donc pas de frontières horizontales.
• Frontières E-pH :
+ − 1 + − 1
◦ Couple H 2 O / H 2 : H 2 O+H +e = H 2+ H 2 O ⇔ H +e = H 2
2 2
0 h
Donc : E 1=E 1+0,06 log
0
...












