Thermodynamique des reactions redox
DownloadTélécharger
Actions
Vote :
ScreenshotAperçu
Informations
Catégorie :Category: mViewer GX Creator Lua TI-Nspire
Auteur Author: omar1998
Type : Classeur 3.6
Page(s) : 10
Taille Size: 784.00 Ko KB
Mis en ligne Uploaded: 12/03/2019 - 17:19:39
Uploadeur Uploader: omar1998 (Profil)
Téléchargements Downloads: 31
Visibilité Visibility: Archive publique
Shortlink : https://tipla.net/a1971365
Type : Classeur 3.6
Page(s) : 10
Taille Size: 784.00 Ko KB
Mis en ligne Uploaded: 12/03/2019 - 17:19:39
Uploadeur Uploader: omar1998 (Profil)
Téléchargements Downloads: 31
Visibilité Visibility: Archive publique
Shortlink : https://tipla.net/a1971365
Description
Sciences Physiques - Chimie MP
Partie G : Électrochimie – Ch.1 : Thermodynamique des réactions redox
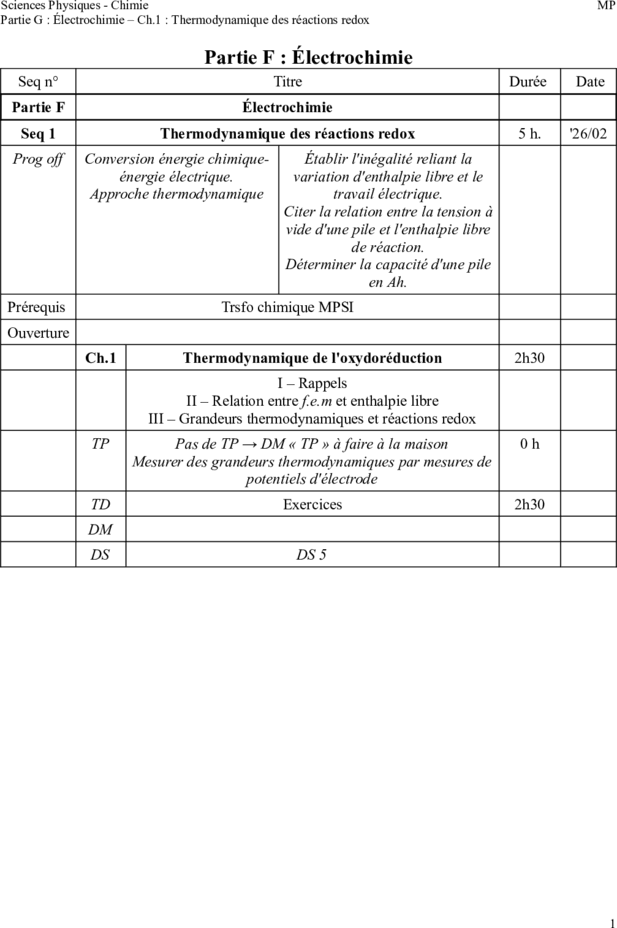
Partie F : Électrochimie
Seq n° Titre Durée Date
Partie F Électrochimie
Seq 1 Thermodynamique des réactions redox 5 h. '26/02
Prog off Conversion énergie chimique- Établir l'inégalité reliant la
énergie électrique. variation d'enthalpie libre et le
Approche thermodynamique travail électrique.
Citer la relation entre la tension à
vide d'une pile et l'enthalpie libre
de réaction.
Déterminer la capacité d'une pile
en Ah.
Prérequis Trsfo chimique MPSI
Ouverture
Ch.1 Thermodynamique de l'oxydoréduction 2h30
I – Rappels
II – Relation entre f.e.m et enthalpie libre
III – Grandeurs thermodynamiques et réactions redox
TP Pas de TP → DM « TP » à faire à la maison 0h
Mesurer des grandeurs thermodynamiques par mesures de
potentiels d'électrode
TD Exercices 2h30
DM
DS DS 5
1
Sciences Physiques - Chimie MP
Partie G : Électrochimie – Ch.1 : Thermodynamique des réactions redox
L'approche adoptée dans cette partie est principalement qualitative, et en dehors de l'étude
thermodynamique d'une pile, elle ne requiert aucun formalisme physique ou mathématique.
Les caractéristiques générales des courbes courant-potentiel sont présentées sur différents exemples
afin que les étudiants soient capables de proposer l'allure qualitative de courbes à partir d'un
ensemble de données cinétiques et thermodynamiques fournies.
Ces courbes sont utilisées pour justifier ou prévoir le fonctionnement de dispositifs d'intérêt
industriel, économique et écologique mettant en jeu la conversion énergie chimique-énergie
électrique ou énergie électrique-énergie chimique, qu'ils soient sièges de réactions d'oxydoréduction
spontanées (piles électrochimiques, pils à combustible, phénomènes de corrosion humide) ou
forcées ( électrolyseurs et accumulateurs).
L'ensemble des aspects étudiés donne lieu à des activités expérimentales qui visent à illustrer les
phénomènes présentés et à souligner l'intérêt des dispositifs électrochimiques pour la détermination
de grandeurs thermodynamiques et électrochimiques.
Les approches documentaires permettent de mettre en évidence la complexité de ces dispositifs de
conversion d'énergie, au-delà de l'aspect strictement électrochimique.
Objectifs :
Les compétences développées sont :
• Choisir de manière rigoureuse et décrire le système physico-chimique étudié ;
• Élaborer qualitativement des outils graphiques à partir d'un ensemble de données ;
• Pratiquer un raisonnement qualitatif à partir de représentations graphiques.
2
Sciences Physiques - Chimie MP
Partie G : Électrochimie – Ch.1 : Thermodynamique des réactions redox
Ch.1 Thermodynamique des réactions redox
L'objectif de ce 1 chapitre est de retrouver les formules d'oxydoréduction vues en 1ere année par
er
une approche thermodynamique de la réaction chimique.
I. Rappels
I.1. Couple Ox/Red et nbre d'oxydation
• Un couple Ox/Red est lié par la demi-équation redox : Ox + n.e- = Red
◦ Une réduction est un gain d'électrons
◦ Une oxydation est une perte d'électrons.
• Le n.o caractérise l'état d'oxydation d'un élément. Plus il est grd, plus l'élément est oxydé.
Ainsi, dans un couple redox, l'oxydant possède le n.o le plus grd. Ce n.o est fonction de
l'électronégativité des éléments qui composent une molécule. La plupart du temps, on a :
n.o(H)=+I et n.o(O)=-II. Le n.o permet d'équilibrer une demi-équation redox.
• Exemples : Déterminer l'oxydant et le réducteur pour les couples suivants et écrire la demi-
équation redox.
H2, H2O O2, H2O MnO4-, Mn2+ Cr3+, Cr2O72-
I.2. Cellules électrochimiques
a. Demi-pile
Une demi-pile correspond à un système physico-chimique siège d'une demi-équation redox.
Une demi-pile peut être constituée (figure 1) :
• Soit d'un conducteur métallique en contact avec un de ses ions : Cu avec Cu2+ (figure 1-a),
Fe avec Fe2+, …
• Soit d'un conducteur inerte en contact avec l'oxydant et le réducteur en solution : Pt avec
Fe2+, Fe3+ (figure 1-b), Pt avec H+, H2, …
a b
Figure 1: Exemples de demi-pile
• L'électrode correspond au conducteur qui assure le transfert d'électrons : Cu, Fe, Pt, …
L'électrode ou a lieu l'oxydation est l'anode, l'électrode ou a lieu la réduction est la cathode.
b. Pile et force électromotrice
La cellule électrochimique est l'association de 2 demi-piles reliées par une jonction
électrolytique permettant le déplacement d'ions : pont salin, paroi poreuse.
La f.e.m est alors la tension à vide de la pile, c'est à dire la tension lorsque le circuit est
ouvert. Expérimentalement, il faut brancher un voltmètre aux bornes de la pile pour obtenir cette
tension (résistance infinie, donc courant quasi nul).
3
Sciences Physiques - Chimie MP
Partie G : Électrochimie – Ch.1 : Thermodynamique des réactions redox
Par convention, l'électrode de gauche est affectée du signe – et l'électrode de droite du signe
+ −
+, et la f.e.m est : e=V −V . La f.e.m standard e0 correspond à la f.e.m de la pile si les
composants sont pris dans leur état standard (gaz à P0=1 bar, soluté à C0=1 mol.L-1).
Exemple : pile Daniell
Schéma Notation
(-) Zn | Zn2+ || Cu2+ | Cu (+)
chgt de jonction
phase
c. Capacité d'une pile
La capacité d'une pile correspond à la charge totale q>0 débitée par la pile.
Soit n le nbre d'électrons échangés lors de la réaction chimique : Ox1+Red2=Ox2+Red1
Soit xf l'avancement final de la réaction, le nombre total d'électrons échangés est : n.xf.NA
La charge totale débitée par la pile est : q=n F ξ f avec F= N A e=96 500 C.mol−1
En terme commercial, la capacité d'une pile s'exprime en Ampère.heure : 1 A.h=3600 C.
Elle est définie comme le courant que peut fournir la pile sur une durée de 1h.
I.3. Potentiel d'électrode ou potentiel redox
a. Définition
Chaque électrode possède un potentiel V+ ou V- appelé potentiel d'électrode. Pour tout couple
Ox/Red, on peut créer une demi-pile et le potentiel d'électrode est alors aussi le potentiel redox
E(Ox/Red). La f.e.m de la pile est alors la différence des potentiels redox à ses bornes.
Exemple : Pour la pile Daniell : e=V +−V −= E (Cu2+ /Cu)−E (Zn 2+ / Zn)
Rq : Le potentiel d'électrode peut être défini comme la différence de potentiel entre le conducteur et
la solution ionique : E=V conducteur−V solution . Ce potentiel dépend de l'interface entre le
conducteur et la solution.
On définit une électrode de référence : l'électrode standard à hydrogène. Elle est liée à la
demi-pile H+/H2, avec une électrode de platine telle que : [H+]=C0=1 mol.L-1 et P(H2)=P0=1 bar.
0 +
On a : E ESH =E (H / H 2 )=0,0 V
b. Mesure
Expérimentalement, le potentiel redox se mesure à l'aide d'une pile constituée de 2 demi-
piles : la borne (+) correspondant au couple redox à mesurer, la borne (-) à l'ESH (figure 2).
+ −
On a alors: e=V −V = E (Ox/Red)−E ESH = E(Ox/Red)
4
Sciences Physiques - Chimie MP
Partie G : Électrochimie – Ch.1 : Thermodynamique des réactions redo...
Partie G : Électrochimie – Ch.1 : Thermodynamique des réactions redox
Partie F : Électrochimie
Seq n° Titre Durée Date
Partie F Électrochimie
Seq 1 Thermodynamique des réactions redox 5 h. '26/02
Prog off Conversion énergie chimique- Établir l'inégalité reliant la
énergie électrique. variation d'enthalpie libre et le
Approche thermodynamique travail électrique.
Citer la relation entre la tension à
vide d'une pile et l'enthalpie libre
de réaction.
Déterminer la capacité d'une pile
en Ah.
Prérequis Trsfo chimique MPSI
Ouverture
Ch.1 Thermodynamique de l'oxydoréduction 2h30
I – Rappels
II – Relation entre f.e.m et enthalpie libre
III – Grandeurs thermodynamiques et réactions redox
TP Pas de TP → DM « TP » à faire à la maison 0h
Mesurer des grandeurs thermodynamiques par mesures de
potentiels d'électrode
TD Exercices 2h30
DM
DS DS 5
1
Sciences Physiques - Chimie MP
Partie G : Électrochimie – Ch.1 : Thermodynamique des réactions redox
L'approche adoptée dans cette partie est principalement qualitative, et en dehors de l'étude
thermodynamique d'une pile, elle ne requiert aucun formalisme physique ou mathématique.
Les caractéristiques générales des courbes courant-potentiel sont présentées sur différents exemples
afin que les étudiants soient capables de proposer l'allure qualitative de courbes à partir d'un
ensemble de données cinétiques et thermodynamiques fournies.
Ces courbes sont utilisées pour justifier ou prévoir le fonctionnement de dispositifs d'intérêt
industriel, économique et écologique mettant en jeu la conversion énergie chimique-énergie
électrique ou énergie électrique-énergie chimique, qu'ils soient sièges de réactions d'oxydoréduction
spontanées (piles électrochimiques, pils à combustible, phénomènes de corrosion humide) ou
forcées ( électrolyseurs et accumulateurs).
L'ensemble des aspects étudiés donne lieu à des activités expérimentales qui visent à illustrer les
phénomènes présentés et à souligner l'intérêt des dispositifs électrochimiques pour la détermination
de grandeurs thermodynamiques et électrochimiques.
Les approches documentaires permettent de mettre en évidence la complexité de ces dispositifs de
conversion d'énergie, au-delà de l'aspect strictement électrochimique.
Objectifs :
Les compétences développées sont :
• Choisir de manière rigoureuse et décrire le système physico-chimique étudié ;
• Élaborer qualitativement des outils graphiques à partir d'un ensemble de données ;
• Pratiquer un raisonnement qualitatif à partir de représentations graphiques.
2
Sciences Physiques - Chimie MP
Partie G : Électrochimie – Ch.1 : Thermodynamique des réactions redox
Ch.1 Thermodynamique des réactions redox
L'objectif de ce 1 chapitre est de retrouver les formules d'oxydoréduction vues en 1ere année par
er
une approche thermodynamique de la réaction chimique.
I. Rappels
I.1. Couple Ox/Red et nbre d'oxydation
• Un couple Ox/Red est lié par la demi-équation redox : Ox + n.e- = Red
◦ Une réduction est un gain d'électrons
◦ Une oxydation est une perte d'électrons.
• Le n.o caractérise l'état d'oxydation d'un élément. Plus il est grd, plus l'élément est oxydé.
Ainsi, dans un couple redox, l'oxydant possède le n.o le plus grd. Ce n.o est fonction de
l'électronégativité des éléments qui composent une molécule. La plupart du temps, on a :
n.o(H)=+I et n.o(O)=-II. Le n.o permet d'équilibrer une demi-équation redox.
• Exemples : Déterminer l'oxydant et le réducteur pour les couples suivants et écrire la demi-
équation redox.
H2, H2O O2, H2O MnO4-, Mn2+ Cr3+, Cr2O72-
I.2. Cellules électrochimiques
a. Demi-pile
Une demi-pile correspond à un système physico-chimique siège d'une demi-équation redox.
Une demi-pile peut être constituée (figure 1) :
• Soit d'un conducteur métallique en contact avec un de ses ions : Cu avec Cu2+ (figure 1-a),
Fe avec Fe2+, …
• Soit d'un conducteur inerte en contact avec l'oxydant et le réducteur en solution : Pt avec
Fe2+, Fe3+ (figure 1-b), Pt avec H+, H2, …
a b
Figure 1: Exemples de demi-pile
• L'électrode correspond au conducteur qui assure le transfert d'électrons : Cu, Fe, Pt, …
L'électrode ou a lieu l'oxydation est l'anode, l'électrode ou a lieu la réduction est la cathode.
b. Pile et force électromotrice
La cellule électrochimique est l'association de 2 demi-piles reliées par une jonction
électrolytique permettant le déplacement d'ions : pont salin, paroi poreuse.
La f.e.m est alors la tension à vide de la pile, c'est à dire la tension lorsque le circuit est
ouvert. Expérimentalement, il faut brancher un voltmètre aux bornes de la pile pour obtenir cette
tension (résistance infinie, donc courant quasi nul).
3
Sciences Physiques - Chimie MP
Partie G : Électrochimie – Ch.1 : Thermodynamique des réactions redox
Par convention, l'électrode de gauche est affectée du signe – et l'électrode de droite du signe
+ −
+, et la f.e.m est : e=V −V . La f.e.m standard e0 correspond à la f.e.m de la pile si les
composants sont pris dans leur état standard (gaz à P0=1 bar, soluté à C0=1 mol.L-1).
Exemple : pile Daniell
Schéma Notation
(-) Zn | Zn2+ || Cu2+ | Cu (+)
chgt de jonction
phase
c. Capacité d'une pile
La capacité d'une pile correspond à la charge totale q>0 débitée par la pile.
Soit n le nbre d'électrons échangés lors de la réaction chimique : Ox1+Red2=Ox2+Red1
Soit xf l'avancement final de la réaction, le nombre total d'électrons échangés est : n.xf.NA
La charge totale débitée par la pile est : q=n F ξ f avec F= N A e=96 500 C.mol−1
En terme commercial, la capacité d'une pile s'exprime en Ampère.heure : 1 A.h=3600 C.
Elle est définie comme le courant que peut fournir la pile sur une durée de 1h.
I.3. Potentiel d'électrode ou potentiel redox
a. Définition
Chaque électrode possède un potentiel V+ ou V- appelé potentiel d'électrode. Pour tout couple
Ox/Red, on peut créer une demi-pile et le potentiel d'électrode est alors aussi le potentiel redox
E(Ox/Red). La f.e.m de la pile est alors la différence des potentiels redox à ses bornes.
Exemple : Pour la pile Daniell : e=V +−V −= E (Cu2+ /Cu)−E (Zn 2+ / Zn)
Rq : Le potentiel d'électrode peut être défini comme la différence de potentiel entre le conducteur et
la solution ionique : E=V conducteur−V solution . Ce potentiel dépend de l'interface entre le
conducteur et la solution.
On définit une électrode de référence : l'électrode standard à hydrogène. Elle est liée à la
demi-pile H+/H2, avec une électrode de platine telle que : [H+]=C0=1 mol.L-1 et P(H2)=P0=1 bar.
0 +
On a : E ESH =E (H / H 2 )=0,0 V
b. Mesure
Expérimentalement, le potentiel redox se mesure à l'aide d'une pile constituée de 2 demi-
piles : la borne (+) correspondant au couple redox à mesurer, la borne (-) à l'ESH (figure 2).
+ −
On a alors: e=V −V = E (Ox/Red)−E ESH = E(Ox/Red)
4
Sciences Physiques - Chimie MP
Partie G : Électrochimie – Ch.1 : Thermodynamique des réactions redo...












