Cinétique des reactions redox
DownloadTélécharger
Actions
Vote :
ScreenshotAperçu
Informations
Catégorie :Category: mViewer GX Creator Lua TI-Nspire
Auteur Author: omar1998
Type : Classeur 3.6
Page(s) : 12
Taille Size: 1.05 Mo MB
Mis en ligne Uploaded: 12/03/2019 - 17:21:04
Uploadeur Uploader: omar1998 (Profil)
Téléchargements Downloads: 32
Visibilité Visibility: Archive publique
Shortlink : https://tipla.net/a1971366
Type : Classeur 3.6
Page(s) : 12
Taille Size: 1.05 Mo MB
Mis en ligne Uploaded: 12/03/2019 - 17:21:04
Uploadeur Uploader: omar1998 (Profil)
Téléchargements Downloads: 32
Visibilité Visibility: Archive publique
Shortlink : https://tipla.net/a1971366
Description
Sciences Physiques - Chimie MP
Partie G : Électrochimie – Ch.2 : Cinétique des réactions redox
Partie F : Électrochimie
Seq n° Titre Durée Date
Partie F Électrochimie
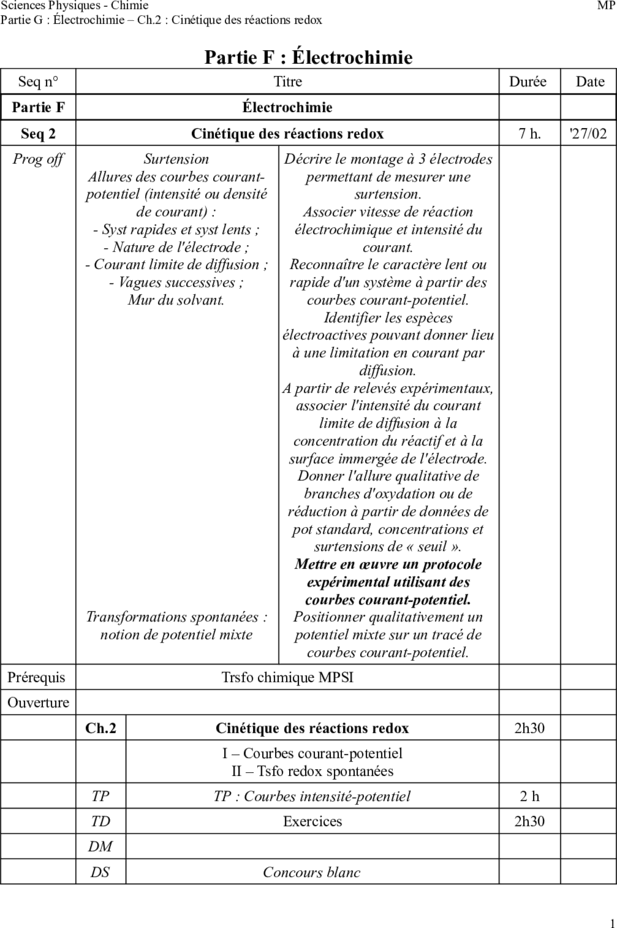
Seq 2 Cinétique des réactions redox 7 h. '27/02
Prog off Surtension Décrire le montage à 3 électrodes
Allures des courbes courant- permettant de mesurer une
potentiel (intensité ou densité surtension.
de courant) : Associer vitesse de réaction
- Syst rapides et syst lents ;
électrochimique et intensité du
- Nature de l'électrode ; courant.
- Courant limite de diffusion ;
Reconnaître le caractère lent ou
- Vagues successives ; rapide d'un système à partir des
Mur du solvant. courbes courant-potentiel.
Identifier les espèces
électroactives pouvant donner lieu
à une limitation en courant par
diffusion.
A partir de relevés expérimentaux,
associer l'intensité du courant
limite de diffusion à la
concentration du réactif et à la
surface immergée de l'électrode.
Donner l'allure qualitative de
branches d'oxydation ou de
réduction à partir de données de
pot standard, concentrations et
surtensions de « seuil ».
Mettre en œuvre un protocole
expérimental utilisant des
courbes courant-potentiel.
Transformations spontanées : Positionner qualitativement un
notion de potentiel mixte potentiel mixte sur un tracé de
courbes courant-potentiel.
Prérequis Trsfo chimique MPSI
Ouverture
Ch.2 Cinétique des réactions redox 2h30
I – Courbes courant-potentiel
II – Tsfo redox spontanées
TP TP : Courbes intensité-potentiel 2h
TD Exercices 2h30
DM
DS Concours blanc
1
Sciences Physiques - Chimie MP
Partie G : Électrochimie – Ch.2 : Cinétique des réactions redox
L'approche adoptée dans cette partie est principalement qualitative, et en dehors de l'étude
thermodynamique d'une pile, elle ne requiert aucun formalisme physique ou mathématique.
Les caractéristiques générales des courbes courant-potentiel sont présentées sur différents exemples
afin que les étudiants soient capables de proposer l'allure qualitative de courbes à partir d'un
ensemble de données cinétiques et thermodynamiques fournies.
Ces courbes sont utilisées pour justifier ou prévoir le fonctionnement de dispositifs d'intérêt
industriel, économique et écologique mettant en jeu la conversion énergie chimique-énergie
électrique ou énergie électrique-énergie chimique, qu'ils soient sièges de réactions d'oxydoréduction
spontanées (piles électrochimiques, pils à combustible, phénomènes de corrosion humide) ou
forcées ( électrolyseurs et accumulateurs).
L'ensemble des aspects étudiés donne lieu à des activités expérimentales qui visent à illustrer les
phénomènes présentés et à souligner l'intérêt des dispositifs électrochimiques pour la détermination
de grandeurs thermodynamiques et électrochimiques.
Les approches documentaires permettent de mettre en évidence la complexité de ces dispositifs de
conversion d'énergie, au-delà de l'aspect strictement électrochimique.
Objectifs :
Les compétences développées sont :
• Choisir de manière rigoureuse et décrire le système physico-chimique étudié ;
• Élaborer qualitativement des outils graphiques à partir d'un ensemble de données ;
• Pratiquer un raisonnement qualitatif à partir de représentations graphiques.
2
Sciences Physiques - Chimie MP
Partie G : Électrochimie – Ch.2 : Cinétique des réactions redox
Ch.2 Cinétique des réactions redox
Nous avons vu comment calculer la f.e.m, càd la tension de la pile pour i=0. De même la
formule de Nernst n'est valable que dans le cas i=0. Or il est évident qu'une pile est destinée à
produire un courant, et il faut alors savoir comment va varier la tension de la pile en fonction du
courant débité. Nous allons ainsi introduire la notion de courbes courant-potentiel.
I. Courbes courant-potentiel I-E
I.1. Position du problème
Il faut bien avoir en tête que :
• Si i=0, le potentiel redox est donné par la formule de Nernst. On va parler de potentiel
aα
d'équilibre et on le note : E eq =E 0 (Ox/Red)+ 0,06 log βOx
n a Red
• Si i≠0, le potentiel redox dépend de i : E (Ox/Red)=E eq+ f (i)
→ Cette dépendance est donnée par les courbes intensité-potentiel.
I.2. Exemple de courbe intensité-potentiel I-E
On prend une demi-pile d'étude constituée d'une électrode de platine et d'une solution
contenant le couple Ox/Red à étudier.
On crée un circuit avec une électrode de référence (ESH, EESH=0,0V) reliée d'une part par un
pont salin à la demi-pile d'étude et d'autre part par une source de tension E montée en opposition
(figure 1). Un ampèremètre permet de mesurer i en fonction de E.
Figure 1: Circuit simple de mesure de courbes
Figure 2: Courbes courant-potentiel
courant-potentiel
• On a : E=E(Ox/Red) – EESH = E(Ox/Red) donc le générateur impose le potentiel redox.
Notons e la f.e.m de la pile ainsi créée. On rappelle que e correspond à la tension à vide de la
pile. On a donc i=0 et e=Eeq.
• Si E=e, alors le système est en équilibre thermodynamique, il ne passe aucun courant : i =0.
aα
On a alors : E=E eq =E 0 (Ox/Red )+ 0,06 log βOx
n a Red
• Si E>e, alors la source de tension impose le passage du courant vers la borne (+), la pile se
comporte en récepteur et il se produit une oxydation à cette borne : Red=Ox+ne- (dans ce
cas, la borne (+) est l'anode) (figure 1). Par convention, on compte positivement le courant
correspondant, qui augmente quand E augmente. On parle de courant anodique (figure 2-a).
3
Sciences Physiques - Chimie MP
Partie G : Électrochimie – Ch.2 : Cinétique des réactions redox
• Si E<e, alors c'est l'inverse, on a réduction à la borne (+) : Ox+ne-=Red. Le courant est
compté négativement. On parle de courant cathodique (figure 2-b).
I.3. Tracé des courbes courant-potentiel
Expérimentalement, si on réalise le montage de la
figure 1 alors l'électrode de référence est aussi soumise à
une intensité ce qui peut faire varier son potentiel et on n'a
plus E=E(Ox/Red).
Pour s’affranchir du problème, il est nécessaire de
réaliser un montage à 3 électrodes (figure 3) :
• L'électrode de référence est protégée par un
voltmètre de résistance infinie. L'intensité qui passe
dans cette électrode est alors négligeable.
L'électrode de référence sera l'électrode au calomel
saturé (ECS).
• L'électrode d'étude (ou de travail : ET) est reliée au
générateur. Figure 3: Montage à 3 électrodes
• Pour fermer le circuit, il est nécessaire d'ajouter une contre-électrode (CE). Cette contre-
électrode ne doit pas influer sur l'intensité.
On peut ainsi mesurer :
• Le potentiel E(Ox/Red) grâce à la tension U du voltmètre : U=E – EECS donc E=U + EECS
• L'intensité i débitée par cet électrode grâce à ampèremètre. On en déduit la courbe courant-
potentiel : i=f(E)
I.4. Lien entre vi...
Partie G : Électrochimie – Ch.2 : Cinétique des réactions redox
Partie F : Électrochimie
Seq n° Titre Durée Date
Partie F Électrochimie
Seq 2 Cinétique des réactions redox 7 h. '27/02
Prog off Surtension Décrire le montage à 3 électrodes
Allures des courbes courant- permettant de mesurer une
potentiel (intensité ou densité surtension.
de courant) : Associer vitesse de réaction
- Syst rapides et syst lents ;
électrochimique et intensité du
- Nature de l'électrode ; courant.
- Courant limite de diffusion ;
Reconnaître le caractère lent ou
- Vagues successives ; rapide d'un système à partir des
Mur du solvant. courbes courant-potentiel.
Identifier les espèces
électroactives pouvant donner lieu
à une limitation en courant par
diffusion.
A partir de relevés expérimentaux,
associer l'intensité du courant
limite de diffusion à la
concentration du réactif et à la
surface immergée de l'électrode.
Donner l'allure qualitative de
branches d'oxydation ou de
réduction à partir de données de
pot standard, concentrations et
surtensions de « seuil ».
Mettre en œuvre un protocole
expérimental utilisant des
courbes courant-potentiel.
Transformations spontanées : Positionner qualitativement un
notion de potentiel mixte potentiel mixte sur un tracé de
courbes courant-potentiel.
Prérequis Trsfo chimique MPSI
Ouverture
Ch.2 Cinétique des réactions redox 2h30
I – Courbes courant-potentiel
II – Tsfo redox spontanées
TP TP : Courbes intensité-potentiel 2h
TD Exercices 2h30
DM
DS Concours blanc
1
Sciences Physiques - Chimie MP
Partie G : Électrochimie – Ch.2 : Cinétique des réactions redox
L'approche adoptée dans cette partie est principalement qualitative, et en dehors de l'étude
thermodynamique d'une pile, elle ne requiert aucun formalisme physique ou mathématique.
Les caractéristiques générales des courbes courant-potentiel sont présentées sur différents exemples
afin que les étudiants soient capables de proposer l'allure qualitative de courbes à partir d'un
ensemble de données cinétiques et thermodynamiques fournies.
Ces courbes sont utilisées pour justifier ou prévoir le fonctionnement de dispositifs d'intérêt
industriel, économique et écologique mettant en jeu la conversion énergie chimique-énergie
électrique ou énergie électrique-énergie chimique, qu'ils soient sièges de réactions d'oxydoréduction
spontanées (piles électrochimiques, pils à combustible, phénomènes de corrosion humide) ou
forcées ( électrolyseurs et accumulateurs).
L'ensemble des aspects étudiés donne lieu à des activités expérimentales qui visent à illustrer les
phénomènes présentés et à souligner l'intérêt des dispositifs électrochimiques pour la détermination
de grandeurs thermodynamiques et électrochimiques.
Les approches documentaires permettent de mettre en évidence la complexité de ces dispositifs de
conversion d'énergie, au-delà de l'aspect strictement électrochimique.
Objectifs :
Les compétences développées sont :
• Choisir de manière rigoureuse et décrire le système physico-chimique étudié ;
• Élaborer qualitativement des outils graphiques à partir d'un ensemble de données ;
• Pratiquer un raisonnement qualitatif à partir de représentations graphiques.
2
Sciences Physiques - Chimie MP
Partie G : Électrochimie – Ch.2 : Cinétique des réactions redox
Ch.2 Cinétique des réactions redox
Nous avons vu comment calculer la f.e.m, càd la tension de la pile pour i=0. De même la
formule de Nernst n'est valable que dans le cas i=0. Or il est évident qu'une pile est destinée à
produire un courant, et il faut alors savoir comment va varier la tension de la pile en fonction du
courant débité. Nous allons ainsi introduire la notion de courbes courant-potentiel.
I. Courbes courant-potentiel I-E
I.1. Position du problème
Il faut bien avoir en tête que :
• Si i=0, le potentiel redox est donné par la formule de Nernst. On va parler de potentiel
aα
d'équilibre et on le note : E eq =E 0 (Ox/Red)+ 0,06 log βOx
n a Red
• Si i≠0, le potentiel redox dépend de i : E (Ox/Red)=E eq+ f (i)
→ Cette dépendance est donnée par les courbes intensité-potentiel.
I.2. Exemple de courbe intensité-potentiel I-E
On prend une demi-pile d'étude constituée d'une électrode de platine et d'une solution
contenant le couple Ox/Red à étudier.
On crée un circuit avec une électrode de référence (ESH, EESH=0,0V) reliée d'une part par un
pont salin à la demi-pile d'étude et d'autre part par une source de tension E montée en opposition
(figure 1). Un ampèremètre permet de mesurer i en fonction de E.
Figure 1: Circuit simple de mesure de courbes
Figure 2: Courbes courant-potentiel
courant-potentiel
• On a : E=E(Ox/Red) – EESH = E(Ox/Red) donc le générateur impose le potentiel redox.
Notons e la f.e.m de la pile ainsi créée. On rappelle que e correspond à la tension à vide de la
pile. On a donc i=0 et e=Eeq.
• Si E=e, alors le système est en équilibre thermodynamique, il ne passe aucun courant : i =0.
aα
On a alors : E=E eq =E 0 (Ox/Red )+ 0,06 log βOx
n a Red
• Si E>e, alors la source de tension impose le passage du courant vers la borne (+), la pile se
comporte en récepteur et il se produit une oxydation à cette borne : Red=Ox+ne- (dans ce
cas, la borne (+) est l'anode) (figure 1). Par convention, on compte positivement le courant
correspondant, qui augmente quand E augmente. On parle de courant anodique (figure 2-a).
3
Sciences Physiques - Chimie MP
Partie G : Électrochimie – Ch.2 : Cinétique des réactions redox
• Si E<e, alors c'est l'inverse, on a réduction à la borne (+) : Ox+ne-=Red. Le courant est
compté négativement. On parle de courant cathodique (figure 2-b).
I.3. Tracé des courbes courant-potentiel
Expérimentalement, si on réalise le montage de la
figure 1 alors l'électrode de référence est aussi soumise à
une intensité ce qui peut faire varier son potentiel et on n'a
plus E=E(Ox/Red).
Pour s’affranchir du problème, il est nécessaire de
réaliser un montage à 3 électrodes (figure 3) :
• L'électrode de référence est protégée par un
voltmètre de résistance infinie. L'intensité qui passe
dans cette électrode est alors négligeable.
L'électrode de référence sera l'électrode au calomel
saturé (ECS).
• L'électrode d'étude (ou de travail : ET) est reliée au
générateur. Figure 3: Montage à 3 électrodes
• Pour fermer le circuit, il est nécessaire d'ajouter une contre-électrode (CE). Cette contre-
électrode ne doit pas influer sur l'intensité.
On peut ainsi mesurer :
• Le potentiel E(Ox/Red) grâce à la tension U du voltmètre : U=E – EECS donc E=U + EECS
• L'intensité i débitée par cet électrode grâce à ampèremètre. On en déduit la courbe courant-
potentiel : i=f(E)
I.4. Lien entre vi...












