ING_MATERIALES
DownloadTélécharger
Actions
Vote :
ScreenshotAperçu
Informations
Catégorie :Category: mViewer GX Creator Prog HP-Prime
Auteur Author: henry jose carnero torres
Type : Basic
Page(s) : 19
Taille Size: 3.84 Mo MB
Mis en ligne Uploaded: 18/12/2016 - 23:57:08
Mis à jour Updated: 18/12/2016 - 23:59:51
Uploadeur Uploader: henry jose carnero torres (Profil)
Téléchargements Downloads: 37
Visibilité Visibility: Archive publique
Shortlink : https://tipla.net/a786451
Type : Basic
Page(s) : 19
Taille Size: 3.84 Mo MB
Mis en ligne Uploaded: 18/12/2016 - 23:57:08
Mis à jour Updated: 18/12/2016 - 23:59:51
Uploadeur Uploader: henry jose carnero torres (Profil)
Téléchargements Downloads: 37
Visibilité Visibility: Archive publique
Shortlink : https://tipla.net/a786451
Description
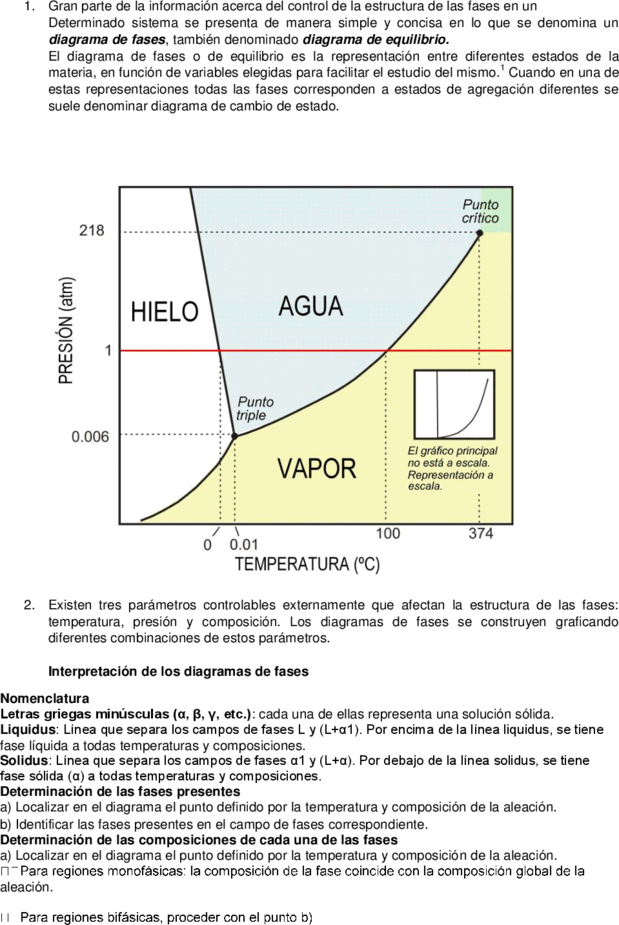
1. Gran parte de la información acerca del control de la estructura de las fases en un
Determinado sistema se presenta de manera simple y concisa en lo que se denomina un
diagrama de fases, también denominado diagrama de equilibrio.
El diagrama de fases o de equilibrio es la representación entre diferentes estados de la
1
materia, en función de variables elegidas para facilitar el estudio del mismo. Cuando en una de
estas representaciones todas las fases corresponden a estados de agregación diferentes se
suele denominar diagrama de cambio de estado.
2. Existen tres parámetros controlables externamente que afectan la estructura de las fases:
temperatura, presión y composición. Los diagramas de fases se construyen graficando
diferentes combinaciones de estos parámetros.
Interpretación de los diagramas de fases
Nomenclatura
Letras griegas minúsculas (α, β, γ, etc.): cada una de ellas representa una solución sólida.
Liquidus: Línea que separa los campos de fases L y (L+α1). Por encima de la línea liquidus, se tiene
fase líquida a todas temperaturas y composiciones.
Solidus: Línea que separa los campos de fases α1 y (L+α). Por debajo de la línea solidus, se tiene
fase sólida (α) a todas temperaturas y composiciones.
Determinación de las fases presentes
a) Localizar en el diagrama el punto definido por la temperatura y composición de la aleación.
b) Identificar las fases presentes en el campo de fases correspondiente.
Determinación de las composiciones de cada una de las fases
a) Localizar en el diagrama el punto definido por la temperatura y composición de la aleación.
aleación.
b) En el punto de interés (definido por la T y la composición) trazar una isoterma, extendiéndose a
través de la región bifásica y terminando en las líneas de límites de fases a cada lado.
c) Observar las intersecciones de la isoterma con los límites de fases a cada lado.
d) Trazar líneas perpendiculares a la isoterma a partir de las intersecciones hasta el eje horizontal de
composiciones.
e) Leer las composiciones de cada fase según cuál es el límite de la región que intercepta la isoterma.
3.
Los equilibrios de fase y sus respectivos diagramas de fase en sistemas multicomponentes tienen
aplicaciones importantes en química, geología y ciencia de los materiales. Por otra parte, los diagramas
de fases son de gran importancia pues apoyan, entre otros, estudios de solidificación, microestructura,
metalurgia física y el "diseño de nuevos materiales".
4.
Diagrama Hierro – Carbono (Fe-C)
Para el estudio de las estructuras de los aceros industriales se necesita, en primer lugar, conocer y
manejar con soltura el diagrama hierro-carbono, que se muestra en la siguiente figura. Esta figura
representa en realidad dos diagramas, el metaestable hierro-carbono y el diagrama estable hierro-
grafito. La cementita no es una fase estable, aunque dada la lentitud de su transformación, el diagrama
metaestable es el que tiene un mayor interés práctico para el estudio de los aceros. El diagrama
estable hierro-grafito solo tiene interés en el estudio de las fundiciones al silicio.
Tomando como base el diagrama metaestable hierro-carbono, se denominan aceros a las aleaciones
binarias con contenidos en carbono menor que 1,76%, mientras que las fundiciones de hierro tienen
contenidos en carbono superiores a 1,76% (hasta aproximadamente 6,67%). Este diagrama muestra
con claridad el comportamiento fuertemente gammáge no del carbono: la adición de carbono al hierro
γ aumenta el dominio térmico de estabilidad de la austenita. Así, por ejemplo, la temperatura
de transformación del hierro γ en hierro α aumenta hasta 1492°C para un contenido en carbono del
0.18% (punto peritéctico del diagrama), mientras que la de la transformación de la austenita en ferrita
disminuye hasta 723°C para la aleación con 0.89% de carbono. El diagrama metaestable hierro-
carbono muestra tres puntos invariantes característicos:
Punto peritéctico(1492°C): Fase líquida(0.4%C) + Fe δ (0.08%C) —>Fe γ (0.18% C)
Punto eutéctico(1130°C):Fase líquida(4.3%C) –>Austenita(1,76%C)+Fe3C (6.67%C)
Punto eutectoide(723°C):Austenita(0.89%C)–> Ferrita (0.025%C) + Fe3C (6.67%C)
Las lineas que delimitan las diferentes regiones del diagrama hierro-carbono identifican las situaciones
en las que tienen lugar cambios estructurales: Las temperaturas de transformación se denominan
temperaturas críticas, existiendo así tres temperaturas de especial interés: A1, A3 Y Acm. Las
temperaturas A1 y A3 son las que respectivamente representan el inicio y el final de la transformación
de la austenita desde el dominio donde están presentes las fases ferrita y cementita, mientras que se
llama temperatura Acm a aquella que separa el dominio de estabilidad de la austenita de la zona
bifásica austenita+cementita. Dado que estas transformaciones no ocurren exactamente a la misma
temperatura al calentar y al enfriar, se denotan a veces como Ar o Ac para describir la transformación
en el enfriamiento o en el calentamiento respectivamente. [14]
Figura 5.1 Diagrama de fases Hierro – Carbono que muestra la relación entre equilibrios
estables de Hierro – Grafito (líneas discontinuas) y las reacciones metaestables de Hierro –
Cementita (líneas continuas). [15]
5.
En el diagrama de fase de Hierro – Carbono se observan las formas alotrópicas del hierro
sólido, BCC y FCC, a distintas temperaturas:
Hierro alfa (α): Su estructura cristalina es BCC con una distancia interatómica de 2.86 Å. Su
temperatura va desde 0º- 910ºC, es relativamente blanda, prácticamente no disuelve en
carbono.
Hierro gamma (γ): También conocida como Austenita. Se presenta de 723 ºC a 1492 ºC.
Cristaliza en la estructura cristalina FCC con mayor volumen que la estructura hierro alfa.
Disuelve fácilmente en carbono (más deformable que la ferrita).
Sus propiedades mecánicas dependen del contenido de carbono, pero podríamos dar como
valores medios representativos: Una dureza de 300HB, una carga de rotura de 900MPa a 1100
MPa y alargamientos comprendidos entre 30 y 60%. [14]
Hierro delta (δ): Está localizada desde 1400 ºC y presenta una reducción en la distancia
interatómica que la hace retornar a una estructura cristalina BCC. Su máxima solubilidad de
carbono es 0.08% a 1492 ºC. No posee una importancia industrial relevante. A partir de 1539
ºC se inicia la fusión del Hierro puro.
6.
Aceros de baja aleación.
Son resistentes, baratos, resistencia mucho mayor que la del acero al carbono
Aceros inoxidables.
Contienen cromo, níquel y otros elementos de aleación.
Duros, muy resistentes y mantienen esa resistencia durante largos periodos a
temperaturas extremas.
Se emplean con fines decorativos.
Utilizados en tuberías, tanques, equipos quirúrgicos.
Aceros al carbono.
Más del 90 % de todos los aceros al carbono.
Contienen menos del 1,65% de marnesio.
Aceros al carbono y baja aleación.
Son de precios moderados, tienen poca cantidad de elementos aleantes , y son
suficientemente ductiles como para conformarce con facilidad.
0.06% a 0.25% de carbonos
7.
El objetivo de los tratamientos térmicos de los metales es mejorar las propiedades de los metales y
aleaciones, por lo general, de
tipo mecánico. En ocasiones se utiliza este tipo de tratamientos para, posteriormente,conformar el
material.
8.
El tratamiento térmico es una operación o combinación de operaciones que comprenden el
calentamiento o enfriamiento del metal, con el fin de mejorar algunas propiedades, en relación con
la condición original del material. Los propósitos generales del tratamiento térmico son la
eliminación de tensiones internas, homogeneización de las estructuras de moldeo, afino de grano y
cambio de estructura.
RECOCIDO TOTAL
Este proceso consiste en el calentamiento del acero a la temperatura adecuada durante un tiempo y
luego enfriar muy lentamente en el interior del horno o en algún material aislaste del calor. Debido al
enfriamiento lento el proceso puede ser asociado al diagrama de equilibrio hierro-carburo de hierro, que
en nuestro caso se trata de una muestra de acero hipoeutectoide y corresponde el proceso al diagrama
siguiente representado en la figura.
El propósito general del recocido es refinar el grano, proporcionar suavidad, mejorar las propiedades
eléctricas y magnéticas y, en algunos casos, mejorar el maquinado.
RECOCIDO PARA LA ELIMINACIÓN DE ESFUERZOS
Este proceso se utiliza para eliminar esfuerzos residuales debidos a un fuerte maquinado u otros
procesos de trabajo en frío. Este recocido, también denominado subcrítico, se lleva a cabo a
temperaturas por debajo de la línea crítica inferior A3.
RECOCIDO DE PROCESO
Es un proceso muy parecido al recocido para eliminar esfuerzos, ya que se calienta el acero a una
temperatura por debajo de la línea crítica inferior. La utilización de este tipo de tratamiento se orienta
hacia las industrias de láminas y cable. Si se aplica después del proceso en frío se suaviza el acero por
medio de la recristalización, para un posterior trabajo.
ESFEROIDIZACIÓN
Es un proceso por el cual se mejora la maquinabilidad. El método que suele emplearse es el
mantenimiento durante un tiempo prolongado a una temperatura ligeramente inferior a la línea crítica
inferior. Este tipo de proces...
Determinado sistema se presenta de manera simple y concisa en lo que se denomina un
diagrama de fases, también denominado diagrama de equilibrio.
El diagrama de fases o de equilibrio es la representación entre diferentes estados de la
1
materia, en función de variables elegidas para facilitar el estudio del mismo. Cuando en una de
estas representaciones todas las fases corresponden a estados de agregación diferentes se
suele denominar diagrama de cambio de estado.
2. Existen tres parámetros controlables externamente que afectan la estructura de las fases:
temperatura, presión y composición. Los diagramas de fases se construyen graficando
diferentes combinaciones de estos parámetros.
Interpretación de los diagramas de fases
Nomenclatura
Letras griegas minúsculas (α, β, γ, etc.): cada una de ellas representa una solución sólida.
Liquidus: Línea que separa los campos de fases L y (L+α1). Por encima de la línea liquidus, se tiene
fase líquida a todas temperaturas y composiciones.
Solidus: Línea que separa los campos de fases α1 y (L+α). Por debajo de la línea solidus, se tiene
fase sólida (α) a todas temperaturas y composiciones.
Determinación de las fases presentes
a) Localizar en el diagrama el punto definido por la temperatura y composición de la aleación.
b) Identificar las fases presentes en el campo de fases correspondiente.
Determinación de las composiciones de cada una de las fases
a) Localizar en el diagrama el punto definido por la temperatura y composición de la aleación.
aleación.
b) En el punto de interés (definido por la T y la composición) trazar una isoterma, extendiéndose a
través de la región bifásica y terminando en las líneas de límites de fases a cada lado.
c) Observar las intersecciones de la isoterma con los límites de fases a cada lado.
d) Trazar líneas perpendiculares a la isoterma a partir de las intersecciones hasta el eje horizontal de
composiciones.
e) Leer las composiciones de cada fase según cuál es el límite de la región que intercepta la isoterma.
3.
Los equilibrios de fase y sus respectivos diagramas de fase en sistemas multicomponentes tienen
aplicaciones importantes en química, geología y ciencia de los materiales. Por otra parte, los diagramas
de fases son de gran importancia pues apoyan, entre otros, estudios de solidificación, microestructura,
metalurgia física y el "diseño de nuevos materiales".
4.
Diagrama Hierro – Carbono (Fe-C)
Para el estudio de las estructuras de los aceros industriales se necesita, en primer lugar, conocer y
manejar con soltura el diagrama hierro-carbono, que se muestra en la siguiente figura. Esta figura
representa en realidad dos diagramas, el metaestable hierro-carbono y el diagrama estable hierro-
grafito. La cementita no es una fase estable, aunque dada la lentitud de su transformación, el diagrama
metaestable es el que tiene un mayor interés práctico para el estudio de los aceros. El diagrama
estable hierro-grafito solo tiene interés en el estudio de las fundiciones al silicio.
Tomando como base el diagrama metaestable hierro-carbono, se denominan aceros a las aleaciones
binarias con contenidos en carbono menor que 1,76%, mientras que las fundiciones de hierro tienen
contenidos en carbono superiores a 1,76% (hasta aproximadamente 6,67%). Este diagrama muestra
con claridad el comportamiento fuertemente gammáge no del carbono: la adición de carbono al hierro
γ aumenta el dominio térmico de estabilidad de la austenita. Así, por ejemplo, la temperatura
de transformación del hierro γ en hierro α aumenta hasta 1492°C para un contenido en carbono del
0.18% (punto peritéctico del diagrama), mientras que la de la transformación de la austenita en ferrita
disminuye hasta 723°C para la aleación con 0.89% de carbono. El diagrama metaestable hierro-
carbono muestra tres puntos invariantes característicos:
Punto peritéctico(1492°C): Fase líquida(0.4%C) + Fe δ (0.08%C) —>Fe γ (0.18% C)
Punto eutéctico(1130°C):Fase líquida(4.3%C) –>Austenita(1,76%C)+Fe3C (6.67%C)
Punto eutectoide(723°C):Austenita(0.89%C)–> Ferrita (0.025%C) + Fe3C (6.67%C)
Las lineas que delimitan las diferentes regiones del diagrama hierro-carbono identifican las situaciones
en las que tienen lugar cambios estructurales: Las temperaturas de transformación se denominan
temperaturas críticas, existiendo así tres temperaturas de especial interés: A1, A3 Y Acm. Las
temperaturas A1 y A3 son las que respectivamente representan el inicio y el final de la transformación
de la austenita desde el dominio donde están presentes las fases ferrita y cementita, mientras que se
llama temperatura Acm a aquella que separa el dominio de estabilidad de la austenita de la zona
bifásica austenita+cementita. Dado que estas transformaciones no ocurren exactamente a la misma
temperatura al calentar y al enfriar, se denotan a veces como Ar o Ac para describir la transformación
en el enfriamiento o en el calentamiento respectivamente. [14]
Figura 5.1 Diagrama de fases Hierro – Carbono que muestra la relación entre equilibrios
estables de Hierro – Grafito (líneas discontinuas) y las reacciones metaestables de Hierro –
Cementita (líneas continuas). [15]
5.
En el diagrama de fase de Hierro – Carbono se observan las formas alotrópicas del hierro
sólido, BCC y FCC, a distintas temperaturas:
Hierro alfa (α): Su estructura cristalina es BCC con una distancia interatómica de 2.86 Å. Su
temperatura va desde 0º- 910ºC, es relativamente blanda, prácticamente no disuelve en
carbono.
Hierro gamma (γ): También conocida como Austenita. Se presenta de 723 ºC a 1492 ºC.
Cristaliza en la estructura cristalina FCC con mayor volumen que la estructura hierro alfa.
Disuelve fácilmente en carbono (más deformable que la ferrita).
Sus propiedades mecánicas dependen del contenido de carbono, pero podríamos dar como
valores medios representativos: Una dureza de 300HB, una carga de rotura de 900MPa a 1100
MPa y alargamientos comprendidos entre 30 y 60%. [14]
Hierro delta (δ): Está localizada desde 1400 ºC y presenta una reducción en la distancia
interatómica que la hace retornar a una estructura cristalina BCC. Su máxima solubilidad de
carbono es 0.08% a 1492 ºC. No posee una importancia industrial relevante. A partir de 1539
ºC se inicia la fusión del Hierro puro.
6.
Aceros de baja aleación.
Son resistentes, baratos, resistencia mucho mayor que la del acero al carbono
Aceros inoxidables.
Contienen cromo, níquel y otros elementos de aleación.
Duros, muy resistentes y mantienen esa resistencia durante largos periodos a
temperaturas extremas.
Se emplean con fines decorativos.
Utilizados en tuberías, tanques, equipos quirúrgicos.
Aceros al carbono.
Más del 90 % de todos los aceros al carbono.
Contienen menos del 1,65% de marnesio.
Aceros al carbono y baja aleación.
Son de precios moderados, tienen poca cantidad de elementos aleantes , y son
suficientemente ductiles como para conformarce con facilidad.
0.06% a 0.25% de carbonos
7.
El objetivo de los tratamientos térmicos de los metales es mejorar las propiedades de los metales y
aleaciones, por lo general, de
tipo mecánico. En ocasiones se utiliza este tipo de tratamientos para, posteriormente,conformar el
material.
8.
El tratamiento térmico es una operación o combinación de operaciones que comprenden el
calentamiento o enfriamiento del metal, con el fin de mejorar algunas propiedades, en relación con
la condición original del material. Los propósitos generales del tratamiento térmico son la
eliminación de tensiones internas, homogeneización de las estructuras de moldeo, afino de grano y
cambio de estructura.
RECOCIDO TOTAL
Este proceso consiste en el calentamiento del acero a la temperatura adecuada durante un tiempo y
luego enfriar muy lentamente en el interior del horno o en algún material aislaste del calor. Debido al
enfriamiento lento el proceso puede ser asociado al diagrama de equilibrio hierro-carburo de hierro, que
en nuestro caso se trata de una muestra de acero hipoeutectoide y corresponde el proceso al diagrama
siguiente representado en la figura.
El propósito general del recocido es refinar el grano, proporcionar suavidad, mejorar las propiedades
eléctricas y magnéticas y, en algunos casos, mejorar el maquinado.
RECOCIDO PARA LA ELIMINACIÓN DE ESFUERZOS
Este proceso se utiliza para eliminar esfuerzos residuales debidos a un fuerte maquinado u otros
procesos de trabajo en frío. Este recocido, también denominado subcrítico, se lleva a cabo a
temperaturas por debajo de la línea crítica inferior A3.
RECOCIDO DE PROCESO
Es un proceso muy parecido al recocido para eliminar esfuerzos, ya que se calienta el acero a una
temperatura por debajo de la línea crítica inferior. La utilización de este tipo de tratamiento se orienta
hacia las industrias de láminas y cable. Si se aplica después del proceso en frío se suaviza el acero por
medio de la recristalización, para un posterior trabajo.
ESFEROIDIZACIÓN
Es un proceso por el cual se mejora la maquinabilidad. El método que suele emplearse es el
mantenimiento durante un tiempo prolongado a una temperatura ligeramente inferior a la línea crítica
inferior. Este tipo de proces...












