Les acides et les bases
DownloadTélécharger
Actions
Vote :
ScreenshotAperçu
Informations
Catégorie :Category: mViewer GX Creator Lua TI-Nspire
Auteur Author: solerem
Type : Classeur 3.6
Page(s) : 7
Taille Size: 322.55 Ko KB
Mis en ligne Uploaded: 01/11/2018 - 15:17:21
Uploadeur Uploader: solerem (Profil)
Téléchargements Downloads: 69
Visibilité Visibility: Archive publique
Shortlink : https://tipla.net/a1768743
Type : Classeur 3.6
Page(s) : 7
Taille Size: 322.55 Ko KB
Mis en ligne Uploaded: 01/11/2018 - 15:17:21
Uploadeur Uploader: solerem (Profil)
Téléchargements Downloads: 69
Visibilité Visibility: Archive publique
Shortlink : https://tipla.net/a1768743
Description
Chapitre 14 Terminale S
Les acides et les bases Les acides et les bases Physique-Chimie
CONTEXTE
La vie étant apparue dans les milieux aqueux et les êtres vivants étant composés majoritairement d'eau, l'étude des
réactions chimiques en solution aqueuse est un domaine central de la chimie.
Parmi ces réactions, les réactions acido-basiques sont au cœur de procédés organiques (la destruction des aliments par
l'estomac, la dégradation par les intestins, etc) ou inorganiques (le principe d'action des déboucheurs d'évier, l'oxydation
des métaux, etc) complexes. L'étude des acides et des bases et la façon dont ils réagissent ensemble est donc
fondamentale.
I Le pH
A La dé nition du pH
DÉFINITION Potentiel hydrogène (pH)
Le potentiel hydrogène, noté pH, est lié à la concentration en ion oxonium [H3 O+ ] par la relation suivante :
pH = −log([H3 O+ ])
EXEMPLE
Pour une solution dont la concentration en ions oxonium est de 1,0.10−4 mol.L−1, le pH sera de :
pH = −log([H3 O+−4])
pH = −log(1, 0.10 )
pH = 4
B La mesure du pH
Le pH se mesure à l'aide :
D'un pH-mètre pour une mesure précise
De papier pH pour une estimation grossière
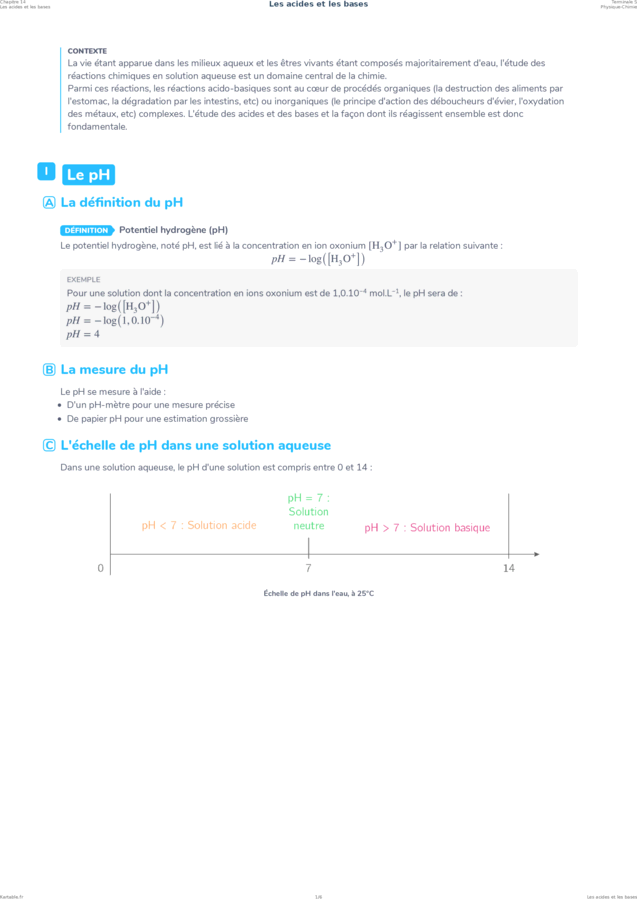
C L'échelle de pH dans une solution aqueuse
Dans une solution aqueuse, le pH d'une solution est compris entre 0 et 14 :
Échelle de pH dans l'eau, à 25°C
Kartable.fr 1/6 Les acides et les bases
Chapitre 14 Terminale S
Les acides et les bases Les acides et les bases Physique-Chimie
II Les acides et les bases
A Les acides et les bases selon Brønsted
DÉFINITION Acide de Brønsted
Un acide de Brønsted est une espèce chimique susceptible de libérer des protons dans un milieu.
EXEMPLE
L'acide chlorhydrique de formule HCl
est un acide au sens de Brønsted car il se dissocie dans l'eau en ions Cl− et H+
HO
(qui sont sous forme d'ions 3 + en solution aqueuse). Il libère donc des protons.
DÉFINITION Base de Brønsted
Une base de Brønsted est une espèce chimique susceptible de capter des protons d'un milieu.
EXEMPLE
La soude de formule NaOH
, se dissocie dans l'eau en ions Na OH
+ et ions − (appelés ions hydroxydes). Ces ions
hydroxydes vont réagir avec des protons pour former de l'eau. La soude est une espèce susceptible de capter des
protons donc une base selon Brønsted.
B Les couples acido-basiques
Lorsqu'un acide, notéAH , est mis dans de l'eau, il se dissocie suivant la réaction que voici :
AH + H 2 O = A − + H O+
3
L'espèce chimique A s'appelle la base conjuguée de l'acide AH . L'acide et sa base conjuguée forment un couple acido-
−
basique noté AH/A− .
EXEMPLE
CH3 COOH) dans l'eau−s'écrit : +
La réaction de dissociation de l'acide éthanoïque (
CH3 COOH + H2 O = CH3 COO− + H3 O
La base conjuguée de l'acide éthanoïque est l'ion éthanoate (CH3 COO ). L'acide et la base conjuguée forment un couple
acido-basique noté CH3 COOH/CH3 COO− .
C Le cas particulier de l'eau
L'eau est à la fois un acide et une base qui intervient dans deux couples acido-basiques :
En tant qu'acide dans le couple 2H O/OH −
H O /H O
En tant que base dans le couple 3 + 2
On dit que l'eau est une espèce amphotère ou que c'est un ampholyte (il en existe d'autres).
DÉFINITION Réaction d'autoprotolyse de l'eau
La réaction d'autoprotolyse de l'eau est la réaction entre l'eau en tant qu'acide et l'eau en tant que base qui s'écrit :
2H2 O < = > H3 O+ + OH−
Cette réaction est caractérisée par le produit ionique de l'eau.
DÉFINITION Produit ionique de l'eau
Le produit ionique de l'eau est le produit dé ni par la relation suivante :
Ke = [H3 O+ ] × [OH− ]
A la température de 25°C :
Ke = 10−14
Kartable.fr 2/6 Les acides et les bases
Chapitre 14 Terminale S
Les acides et les bases Les acides et les bases Physique-Chimie
III L'équilibre acido-basique
A Les acides forts et les bases fortes
Les acides forts et les bases fortes sont des acides et des bases pour lesquels la réaction avec l'eau est totale :
AH− + H2 O ⟶ A− + H3 O−+
A + H2 O ⟶ AH + OH
L'équation d'une réaction totale s'écrit avec une èche à sens unique ( ⟶) tournée dans le sens de
formation des produits.
REMARQUE
EXEMPLE
L'acide chlorhydrique ou l'acide sulfurique sont des exemples d'acides forts tandis que la soude est un exemple de base
forte.
B Les acides et les bases faibles
Les acides et les bases faibles sont des acides et des bases pour lesquels la réaction avec l'eau n'est pas totale :
AH− + H2 O < = > A− + H3 O−+
A + H2 O < = > AH + OH
Les réactions sont dites équilibrées.
L'équation d'une réaction équilibrée s'écrit en utilisant deux èches de sens opposé ( −⇀
↽−).
REMARQUE
DÉFINITION État d'équilibre chimique
Une réaction chimique atteint un état d'équilibre chimique lorsque le système n'évolue plus alors que tous les réactifs sont
encore présents. Cet état est caractérisé par une constante d'équilibre.
C La constante d'acidité
DÉFINITION Constante d'acidité Ka
La constante d'acidité Ka est la constante qui caractérise la réaction de dissociation d'un acide faible AH.
FORMULE Constante d'acidité Ka
La constante d'acidité Ka d'un couple acido-basique AH/A− est liée aux concentrations des espèces chimiques présentes à
l'équilibre, par la formule suivante :
[ A
...
Les acides et les bases Les acides et les bases Physique-Chimie
CONTEXTE
La vie étant apparue dans les milieux aqueux et les êtres vivants étant composés majoritairement d'eau, l'étude des
réactions chimiques en solution aqueuse est un domaine central de la chimie.
Parmi ces réactions, les réactions acido-basiques sont au cœur de procédés organiques (la destruction des aliments par
l'estomac, la dégradation par les intestins, etc) ou inorganiques (le principe d'action des déboucheurs d'évier, l'oxydation
des métaux, etc) complexes. L'étude des acides et des bases et la façon dont ils réagissent ensemble est donc
fondamentale.
I Le pH
A La dé nition du pH
DÉFINITION Potentiel hydrogène (pH)
Le potentiel hydrogène, noté pH, est lié à la concentration en ion oxonium [H3 O+ ] par la relation suivante :
pH = −log([H3 O+ ])
EXEMPLE
Pour une solution dont la concentration en ions oxonium est de 1,0.10−4 mol.L−1, le pH sera de :
pH = −log([H3 O+−4])
pH = −log(1, 0.10 )
pH = 4
B La mesure du pH
Le pH se mesure à l'aide :
D'un pH-mètre pour une mesure précise
De papier pH pour une estimation grossière
C L'échelle de pH dans une solution aqueuse
Dans une solution aqueuse, le pH d'une solution est compris entre 0 et 14 :
Échelle de pH dans l'eau, à 25°C
Kartable.fr 1/6 Les acides et les bases
Chapitre 14 Terminale S
Les acides et les bases Les acides et les bases Physique-Chimie
II Les acides et les bases
A Les acides et les bases selon Brønsted
DÉFINITION Acide de Brønsted
Un acide de Brønsted est une espèce chimique susceptible de libérer des protons dans un milieu.
EXEMPLE
L'acide chlorhydrique de formule HCl
est un acide au sens de Brønsted car il se dissocie dans l'eau en ions Cl− et H+
HO
(qui sont sous forme d'ions 3 + en solution aqueuse). Il libère donc des protons.
DÉFINITION Base de Brønsted
Une base de Brønsted est une espèce chimique susceptible de capter des protons d'un milieu.
EXEMPLE
La soude de formule NaOH
, se dissocie dans l'eau en ions Na OH
+ et ions − (appelés ions hydroxydes). Ces ions
hydroxydes vont réagir avec des protons pour former de l'eau. La soude est une espèce susceptible de capter des
protons donc une base selon Brønsted.
B Les couples acido-basiques
Lorsqu'un acide, notéAH , est mis dans de l'eau, il se dissocie suivant la réaction que voici :
AH + H 2 O = A − + H O+
3
L'espèce chimique A s'appelle la base conjuguée de l'acide AH . L'acide et sa base conjuguée forment un couple acido-
−
basique noté AH/A− .
EXEMPLE
CH3 COOH) dans l'eau−s'écrit : +
La réaction de dissociation de l'acide éthanoïque (
CH3 COOH + H2 O = CH3 COO− + H3 O
La base conjuguée de l'acide éthanoïque est l'ion éthanoate (CH3 COO ). L'acide et la base conjuguée forment un couple
acido-basique noté CH3 COOH/CH3 COO− .
C Le cas particulier de l'eau
L'eau est à la fois un acide et une base qui intervient dans deux couples acido-basiques :
En tant qu'acide dans le couple 2H O/OH −
H O /H O
En tant que base dans le couple 3 + 2
On dit que l'eau est une espèce amphotère ou que c'est un ampholyte (il en existe d'autres).
DÉFINITION Réaction d'autoprotolyse de l'eau
La réaction d'autoprotolyse de l'eau est la réaction entre l'eau en tant qu'acide et l'eau en tant que base qui s'écrit :
2H2 O < = > H3 O+ + OH−
Cette réaction est caractérisée par le produit ionique de l'eau.
DÉFINITION Produit ionique de l'eau
Le produit ionique de l'eau est le produit dé ni par la relation suivante :
Ke = [H3 O+ ] × [OH− ]
A la température de 25°C :
Ke = 10−14
Kartable.fr 2/6 Les acides et les bases
Chapitre 14 Terminale S
Les acides et les bases Les acides et les bases Physique-Chimie
III L'équilibre acido-basique
A Les acides forts et les bases fortes
Les acides forts et les bases fortes sont des acides et des bases pour lesquels la réaction avec l'eau est totale :
AH− + H2 O ⟶ A− + H3 O−+
A + H2 O ⟶ AH + OH
L'équation d'une réaction totale s'écrit avec une èche à sens unique ( ⟶) tournée dans le sens de
formation des produits.
REMARQUE
EXEMPLE
L'acide chlorhydrique ou l'acide sulfurique sont des exemples d'acides forts tandis que la soude est un exemple de base
forte.
B Les acides et les bases faibles
Les acides et les bases faibles sont des acides et des bases pour lesquels la réaction avec l'eau n'est pas totale :
AH− + H2 O < = > A− + H3 O−+
A + H2 O < = > AH + OH
Les réactions sont dites équilibrées.
L'équation d'une réaction équilibrée s'écrit en utilisant deux èches de sens opposé ( −⇀
↽−).
REMARQUE
DÉFINITION État d'équilibre chimique
Une réaction chimique atteint un état d'équilibre chimique lorsque le système n'évolue plus alors que tous les réactifs sont
encore présents. Cet état est caractérisé par une constante d'équilibre.
C La constante d'acidité
DÉFINITION Constante d'acidité Ka
La constante d'acidité Ka est la constante qui caractérise la réaction de dissociation d'un acide faible AH.
FORMULE Constante d'acidité Ka
La constante d'acidité Ka d'un couple acido-basique AH/A− est liée aux concentrations des espèces chimiques présentes à
l'équilibre, par la formule suivante :
[ A
...












